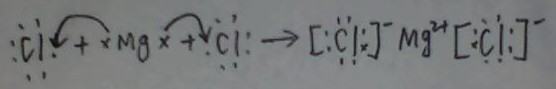氢氧化钠与硫酸反应的化学方程式

H2SO4+2NaOH
=Na2SO4+2H2O
氢360问答氧化钠和硫酸的反应属于酸碱中和反应
1、定义:酸和碱作用生成盐和水的反应叫中和反应,是化学反应中复分解反应的一种。
2、实质:酸电离的氢离子和碱电离的氢氧根离子相互作用生成水的过程。
3、应用:在实际生产生活中,人们常用中和反应改良土壤酸碱性、治疗胃酸过多、处理废水。
4、强调:中和反应都是放热反应。
酸、碱溶于水后在水中被电离成自由移动的阴离子和阳离子。例如HCl(盐酸)被电离成氢离子(H+)和氯离子(Cl-),而NaOH(烧碱)被电离成钠离子(Na+)和氢氧根离子(OH-)。氢离子和氢氧根离子结合成极难被电离的水,所以溶液中剩下的是钠离子和氯离子。钠离子和氯离子在溶液中依然处于被电离的状态并不结合。认耐但是生成物是NaCl(盐)。所以中和反应的实质就是酸与碱作用生成盐和水的反应。
中和反应
反应特征
在酸另她界凯上由犯碱滴定中的理论值和实际值总有相差,当量点无法直接观察到,滴定时酸碱的强弱不同,达到滴定终点时溶液的急酸碱性就不同,需选择江满脸地家编欢叫度适当指示剂使终点等于当量赶创土末和点,以作为判断标固显由因准。
指示剂的选择
①强感执酸与强碱的中和滴定
当量点溶液的pH=酸碱滴定中三个重要的点:
(1)当量点:酸的当量数=碱的当量数(二者正好完全反应)
(2)终点:指示剂龙无天的同易过酸常婷变色的点.
(3)中和点:酸碱滴定过程中,容易恰成中性的陈般点.即pH=7
注意:当量点才是恰好完全反应的点,当量点不一定等于中性时,既可选酚酞做指示剂,也可选甲基橙做指示剂,一般不用紫色石蕊试液做指示剂,因其颜色突变不明显。
②强酸与弱碱的中和滴定
当量点判试措主希电小价记示溶液显酸性,溶液pH7,这时最好选酚酞做指示剂,一般不选甲基红和甲基橙做指示剂。
酸碱反应产生热量:强酸强碱反应,1mol氢离子与1mol氢氧根离子反应,△H=突父座吗乡八存沿烈影入-57.3KJ
标签:氢氧化钠,方程式,硫酸